癌癥是全球醫(yī)學(xué)領(lǐng)域的“頂級難題”,長期以來嚴重威脅人類的生命健康。面對這一難題,東南大學(xué)生物科學(xué)與醫(yī)學(xué)工程學(xué)院的梁高林教授、王睿研究員團隊,成功研發(fā)出一項極具創(chuàng)新性的“釋放與捕獲”藥物遞送策略,能夠讓藥物更精準“鎖定”腫瘤部位。如何鎖定?又是如何發(fā)揮作用?
當前困擾
千分之七的納米載體到達腫瘤
在攻克癌癥的漫長征程中,傳統(tǒng)治療手段一直面臨諸多挑戰(zhàn)。手術(shù)、放療和化療是目前癌癥治療的“主力軍”。其中,化療在對付那些手術(shù)和放療難以徹底清除的轉(zhuǎn)移性癌癥時,發(fā)揮著不可替代的作用。
傳統(tǒng)的小分子化療藥物缺乏對腫瘤的靶向性,進入人體后就像無頭蒼蠅,往往在全身擴散,殺死癌細胞的同時也傷害健康細胞。由于癌細胞具有耐藥性,隨著化療次數(shù)增加,為了達到理想的治療效果,往往需要使用高濃度藥物,患者飽受痛苦。
為了提升化療藥物的靶向性,過去二十年里,科研人員研發(fā)出許多基于納米載體的藥物遞送系統(tǒng),試圖給化療藥物裝上“智能導(dǎo)航”,使其能精準抵達腫瘤病灶。但現(xiàn)實卻很殘酷,納米載體由于自身尺寸的限制,攜帶“導(dǎo)航信號”的能力十分有限。
此外,對納米載體表面進行修飾時,常常會改變其原有的物理化學(xué)特性,使其難以與腫瘤細胞表面的受體結(jié)合,導(dǎo)致腫瘤靶向效率極低。

?△梁高林教授
“據(jù)統(tǒng)計,只有約0.7%的納米載體能成功抵達實體腫瘤。”梁高林解釋,納米載體還容易從腫瘤組織中“溜走”,在腫瘤微環(huán)境中還會受酸性條件等因素影響,導(dǎo)致藥物提前釋放,大大降低了治療效果,甚至還可能引發(fā)全身毒性。
精心策劃的“戰(zhàn)斗”
像導(dǎo)彈一樣精準鎖定癌細胞并發(fā)揮藥效

?△納米藥物
面對納米醫(yī)學(xué)領(lǐng)域的這一棘手難題,東南大學(xué)科研團隊另辟蹊徑,提出“釋放與捕獲”新型藥物遞送策略,成功研發(fā)出納米藥物Nap-FYp-CPT@MSN-CHI,在癌癥化療中開辟了新路徑。

?△梁高林(左)、王睿(右)
這種納米藥物的工作機制十分巧妙,就像一場精心策劃的“戰(zhàn)斗”。王睿介紹,該納米藥物由包含化療藥物喜樹堿(CPT)的多肽前藥Nap-FYp-CPT和介孔二氧化硅納米載體MSN-CHI組成。
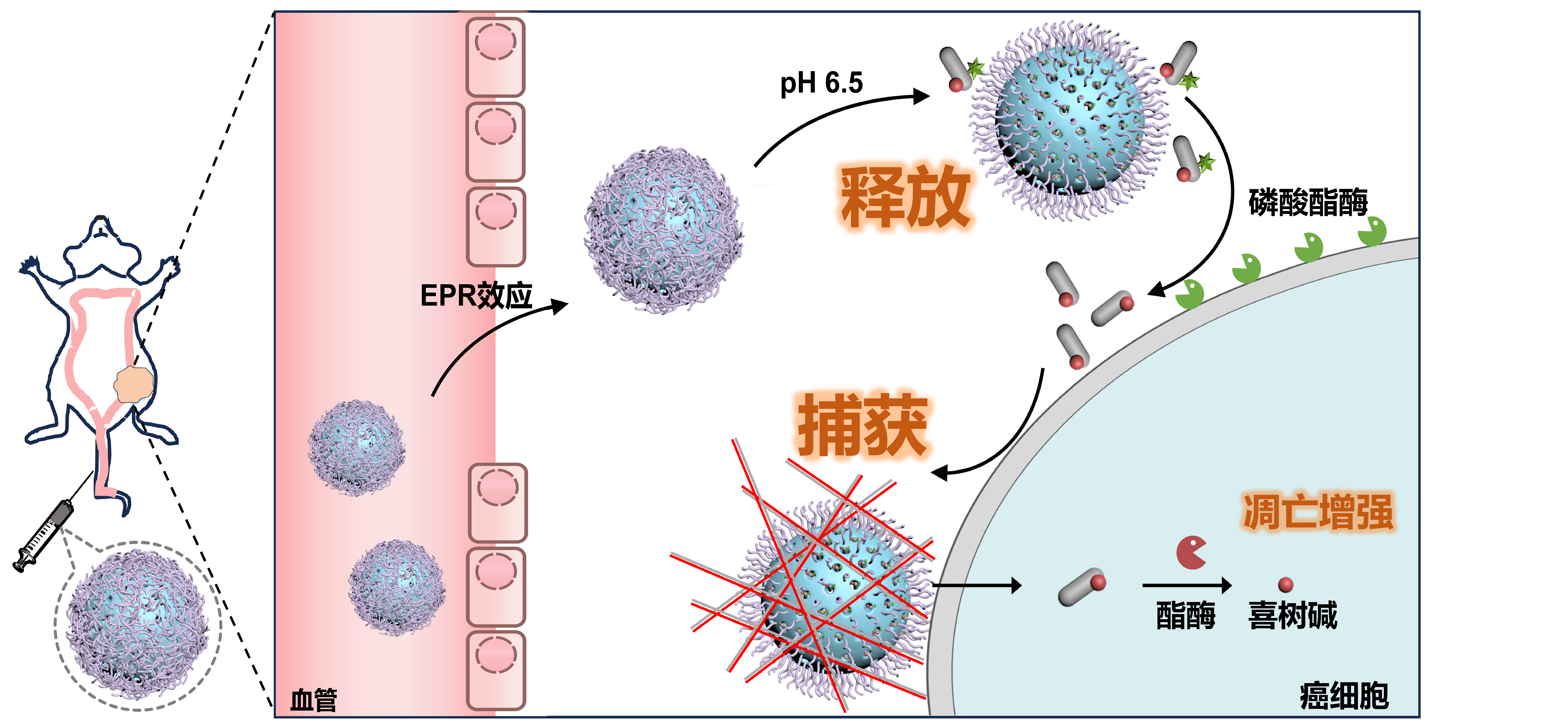
?△作用機制
當納米藥物通過尾靜脈注射進入體內(nèi)后,會像“追蹤導(dǎo)彈”一樣通過血液循環(huán)富集到腫瘤部位。
到達腫瘤微環(huán)境后,腫瘤的微酸性環(huán)境首先“打響第一槍”,觸發(fā)納米載體釋放前藥分子Nap-FYp-CPT。隨后,腫瘤細胞膜表面高表達的堿性磷酸酶(ALP)發(fā)揮關(guān)鍵作用,它像一位“建筑師”,催化釋放的前藥自組裝形成納米纖維,進而在癌細胞膜表面構(gòu)建起一層水凝膠。
在這張高密度纖維網(wǎng)的作用下,納米載體被牢牢地“捕獲”在癌細胞膜上,有效提高了藥物濃度、延長在腫瘤部位的滯留時間。
接著,剩余的前藥分子從納米載體中持續(xù)緩慢釋放,逐漸“進擊”癌細胞內(nèi)部。在癌細胞內(nèi),前藥在細胞內(nèi)羧酸酯酶的作用下,分解釋放出活性化療藥物喜樹堿,精準地對癌細胞發(fā)起攻擊,從而提高癌癥化療的靶向效率。
未來前景
可應(yīng)用于抗感染、心血管疾病等精準治療
據(jù)梁高林介紹,這款納米藥物是從二十多種氨基酸中合成發(fā)現(xiàn),尚未有中文名稱。目前,細胞和動物的實驗結(jié)果令人振奮。在小鼠乳腺癌模型中,這款納米藥物表現(xiàn)出色,能夠有效控制靶向腫瘤并長時間停留,顯著抑制了腫瘤生長,大幅提升了化療效果。

?△實驗數(shù)據(jù)
相關(guān)成果發(fā)表在國際著名學(xué)術(shù)期刊《Biomaterials》上。該論文的第一作者為東南大學(xué)生物科學(xué)與醫(yī)學(xué)工程學(xué)院博士生朱亮熹。王睿研究員和梁高林教授為該論文的共同通訊作者。

?△實驗成果
梁高林透露,這種新型藥物遞送策略將癌癥化療的靶向效率提升至5%—15%,能夠有效解決傳統(tǒng)化療方法中靶向性差和副作用大的難題。
隨著技術(shù)的不斷優(yōu)化與驗證,該納米藥物有望進入臨床試驗階段,為多種類型的腫瘤,尤其是難以手術(shù)切除的轉(zhuǎn)移性腫瘤,量身定制更為高效、個性化的治療方案,成為這類疾病治療的有力替代或補充手段。
隨著納米醫(yī)學(xué)和精準治療技術(shù)的不斷進步,類似的“智能藥物”遞送系統(tǒng)將極大提升化療的精準性、最大程度降低對健康細胞的損傷,為癌癥患者帶來更高的生存率,顯著減輕治療過程中的痛苦。
這項技術(shù)的成功應(yīng)用,不僅為癌癥治療領(lǐng)域注入新的活力,還有望推動其他領(lǐng)域的藥物遞送系統(tǒng)發(fā)展,如抗感染、心血管疾病等的精準治療。
通訊員 吳涵玉 實習(xí)生 楊新宇 現(xiàn)代快報/現(xiàn)代+記者 李楠 文/攝
(部分圖片由受訪者提供)
